Ma première participation aux JFBTM, « Implication de l’Ostéopontine dans la réparation naturelle d’un défaut osseux », remonte aux 9èmes journées organisées à Lyon (2006). J’étais alors en Master 2 de Biologie Cellulaire et Physiopathologie à l’université Bordeaux 2, après un parcours alternant études universitaires et postes de technicien/assistant ingénieur (Service d’anatomie pathologique, CHU de Bordeaux ; GREF Université Bordeaux2).
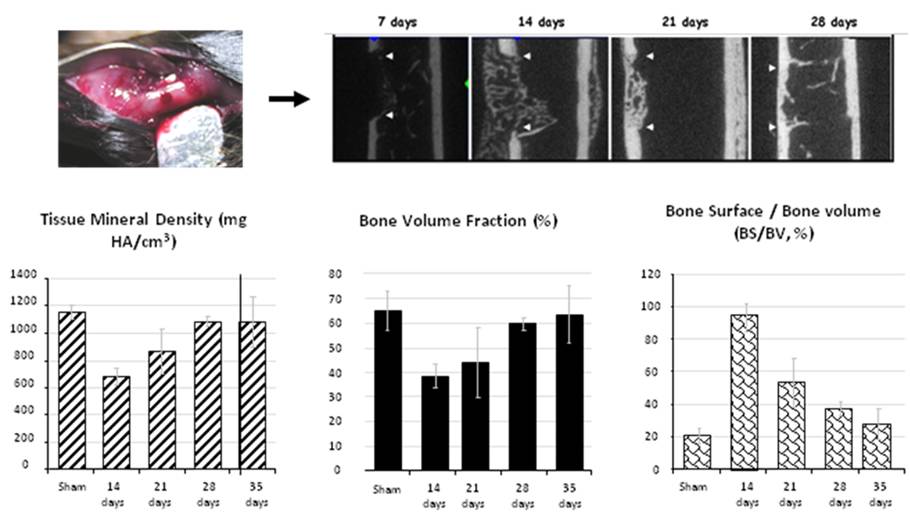
Suite à mon expérience positive aux JFBTM, j’ai poursuivi mes travaux au cours d’une thèse (2006-2009), sous la direction d’Olivier Chassande au sein de l’unité INSERM U577 (devenue aujourd’hui U1026 BioTis) grâce à un financement MENRT et à un poste de moniteur. Au cours de mon doctorat, je me suis particulièrement intéressé au rôle de deux protéines de la famille des SIBLINGs : l’Ostéopontine et la Sialoprotéine osseuse, dans la réparation naturelle de l’os cortical diaphysaire et de l’os trabéculaire (épi-métaphysaire). Ce projet de recherche m’a permis d’élaborer des modèles de réparation osseuse et de m’épanouir avec des techniques classiques telles que l’histologie mais également avec l’imagerie par tomographie aux rayons X (figure 1) [1,2]. Par ailleurs, au cours de ces trois années, j’ai bénéficié de l’expérience en ingénierie tissulaire osseuse de Joëlle Amédée, Reine Bareille, Laurence Bordenave et de l’ensemble des membres du laboratoire. Cet environnement de travail a pesé fortement dans le choix de mon post-doc dans ce domaine.
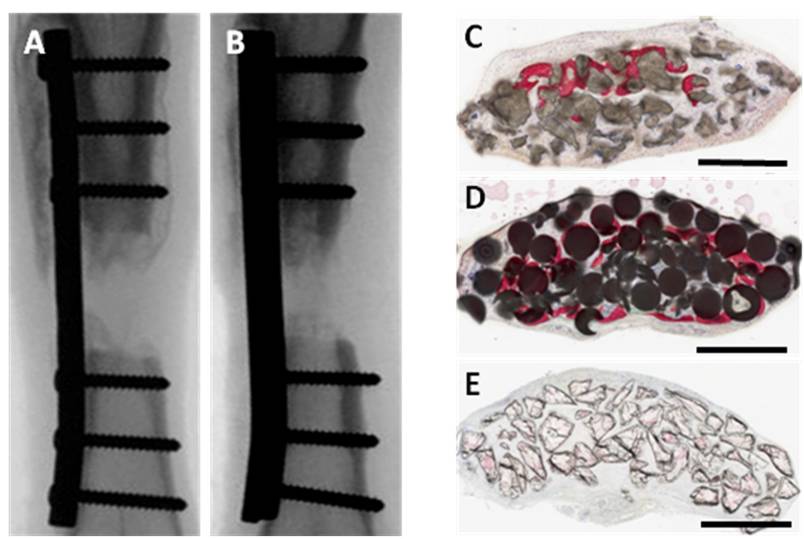
Ainsi, en décembre 2009, j’ai intégré le laboratoire de « Bioingénierie et Biomécanique ostéoarticulaires », UMR-CNRS 7052-Université Paris 7, dirigé par Hervé Petite, pour une durée de deux ans. J’ai été recruté sur le projet ANR GlassBone, dirigé par Delphine Logeart-Avramoglou. Ce projet visait à optimiser les conditions de préparation des produits d’ingénierie tissulaire et s’articulait autour de trois axes : la recherche d’une matrice en céramique optimale pour la formation osseuse; la survie post-implantation des cellules constituant les matériaux cellularisés, et enfin le préconditionnement pour promouvoir la viabilité cellulaire in vivo. Ce projet a été pour moi l’occasion d’appréhender de nouvelles techniques d’analyses et modèles d’études (cytométrie en flux, préparation de vecteurs rétroviraux, imagerie par bioluminescence, grande perte osseuse chez la brebis) (figure 2) [3, 4]. Ces années de post-doctorat ont également été celles de la préparation des concours (MCU, CR).
Depuis janvier 2012, j’ai rejoint le centre de Recherches INRA de Clermont-Ferrand dans l’Unité de Nutrition Humaine (UMR1019) au sein de l’équipe Alimentation Squelette et Métabolisme (voir Archives du site : Focus sur l’UMR1019). L’objectif de cette équipe, sous la direction de Véronique Coxam, est la prévention nutritionnelle de la santé osseuse, particulièrement dans le cadre de pathologies ostéoarticulaires telles que l’ostéoporose. Afin de proposer des stratégies nutritionnelles intégrées, je me suis orienté vers la prévention de la santé articulaire et notamment celle du cartilage articulaire, dans le contexte de l’arthrose. L’arthrose est une pathologie présentant une forte prévalence dans la population, et associée à une gêne fonctionnelle importante avec douleurs. Développer des stratégies de prophylaxie est donc un enjeu sociétal important. Ce nouveau projet et cette nouvelle fonction représentent pour moi de nouvelles perspectives de travail et de nouveaux défis scientifiques. J’espère bientôt partager l’avancée de ce nouveau projet avec la communauté de la SFBTM, lors de prochaines JFBTM.
Quelques informations concernant mon expérience avec la SFBTM :
Nombre de participations aux JFBTM : 3 (en thèse : 1 poster, 2 communications orales)
Nombres de Prix JFBTM : 2 (1 poster- 1 oral)
Soutien financier SFBTM : 1 bourse d’échange inter-laboratoires (2007)
Quelques illustrations :
Figure 1 : Réparation d’un défaut osseux diaphysaire chez la souris. Analyse par tomographie haute résolution aux rayons X (GE healthcare).
Figure 2 : Principaux résultats du projet de recherche Glassbone. Comparaison du potentiel ostéoconducteur de matériaux non cellularisés, corail (A) et verre bioactif (B), dans un défaut osseux de taille critique dans le métatarsien chez la brebis. Radiographies à quatre mois post-implantation. Potentiel ostéogène de matériaux cellularisés, corail (C), HAP/bTCP (D), verre bioactif (E), dans un modèle d’implantation sous-cutané chez la souris. Histologie non décalcifiée à deux mois postimplantation– coloration Picrofushine (tissu osseux en rouge) et bleu de stévenel. [4]
Quelques remerciements adressés à :
– L’ex U577 avec notamment Reine, Joëlle, Murielle, Olivier et tous les autres membres de l’unité pour m’avoir permis de m’intégrer dans la communauté scientifique au travers d’une thèse enrichissante.
– L’ensemble du B2OA et particulièrement Delphine et Hervé, pour la confiance et la liberté qu’ils m’ont accordé et leur soutien.
– A mon équipe actuelle, en espérant faire d’excellentes découvertes ensemble.
Quelques références :
1. Monfoulet, L., et al., Drilled hole defects in mouse femur as models of intramembranous cortical and cancellous bone regeneration. Calcif Tissue Int, 2010. 86(1): p. 72-81
2. Monfoulet, L., et al., Bone sialoprotein, but not osteopontin, deficiency impairs the mineralization of regenerating bone during cortical defect healing. Bone, 2010. 46(2): p. 447-52
3. Petite, H., et al., Strategies for improving the efficacy of bioengineered bone constructs: a perspective. Osteoporos Int, 2011. 22(6): p. 2017-21
4. Monfoulet, L., et al., Improvement of stem-cell based bone construct for the repair of massive bone defects. IRBM, 2012. 33(2): p. 73-77